D11-1 抗体様分子標的HLHペプチドの開発
疾患関連タンパク質に対する分子標的ペプチドのスクリーニング、分子標的ペプチドの合成・機能解析・試料提供
[1] 支援担当者
| 所属 | ①大阪府立大学 大学院理学系研究科 | |
|---|---|---|
| 氏名 | ①藤井 郁雄 | |
| AMED 事業 |
ユニット/領域名 課題名 |
ケミカルシーズ・リード 探索ユニット(ライブラリー・スクリーニング領域) ポスト抗体医薬:進化分子工学による分子標的ペプチドの開発 |
| 代表機関 代表者 |
大阪府立大学 藤井 郁雄 |
|
| 支援技術のキーワード | ポスト抗体医薬、分子標的ペプチド、立体構造規制ペプチド、ファージ表層提示ライブラリー | |
[2] 支援技術の概要
支援先より提供される標的タンパク質(疾患関連タンパク質など)に対して、独自の分子標的HLHペプチド・ライブラリーをスクリーニングして、目的とする分子標的HLHペプチドを供給する。この分子標的HLHペプチドは、標的タンパク質に対し強い結合活性をもち、タンパク質?タンパク質相互作用を阻害する。また,強固なヘリックス構造を保持していることから、血中での酵素分解に対する高い安定性を示す。さらに、動物実験(マウス)により,免疫原性をもたないことを確認している。すなわち、分子標的HLHペプチドは、抗体と同等の結合活性と安定性をもっており、生物学的ツール及び医薬品としての有用性を確認している。
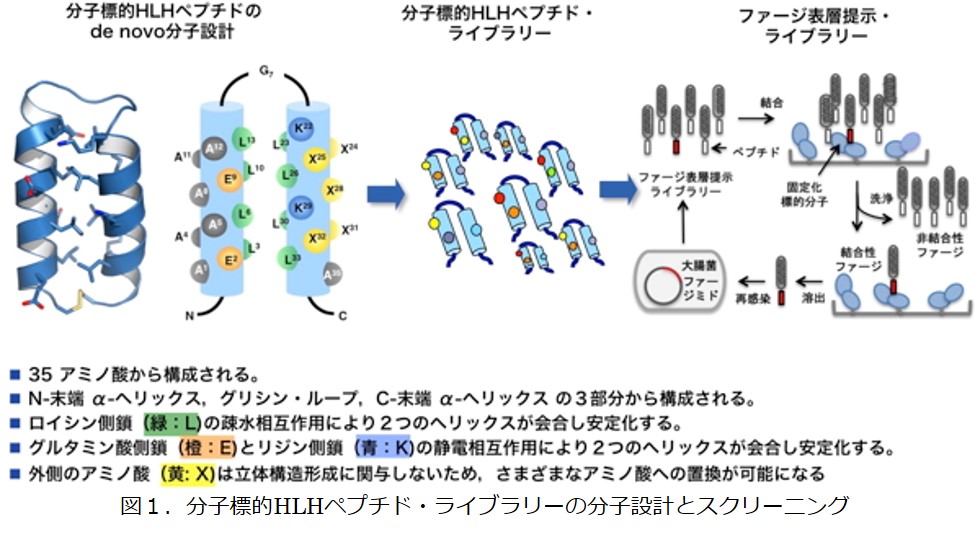
当研究室では、ポスト抗体医薬の候補分子として,ヘリックス?ループ?ヘリックス構造モチーフをもつ立体構造規制ペプチド(分子標的HLHペプチド)を設計した(図1)。このペプチドは3つの領域で構成される[①N末端ヘリックス(14アミノ酸残基からなる構造支持領域)、②ループ(Gly 7残基からなるリンカー)、③C末端ヘリックス(14アミノ酸残基からなる相互作用領域)]。2つのヘリックスは、内側に存在するLeu基の疎水相互作用及び側面のGlu基とLys基の静電相互作用により寄り添い、安定な構造を形成する。一方、ヘリックス外側のアミノ酸は立体構造構築に関わっていない。したがって、外側のアミノ酸(X部分)を様々なアミノ酸に置換することにより、同一構造のペプチド・ライブラリーを構築することができる。このライブラリーを提示させ(ファージ表層提示ライブラリー)させ,各種標的タンパク質(疾患関連タンパク質)に対してスクリーニングし、強い結合活性をもつ分子標的HLHペプチドの獲得に成功している。
これまでに、図2のような相互作用トポロジー(ランダム変異部位)の異なる4種の分子標的HLHペプチド・ライブラリーを構築し,またアミノ酸の種類の違いにより,17種のライブラリーを保有している(各ライブラリーサイズ>1x109)。
[3] 支援技術の利用例
抗体様物質として、安定なヘリックス-ル-プ-ヘリックス構造をもつペプチド「分子標的HLHペプチド」の開発を行っている。進化分子工学的手法により、すでに、各種のサイトカインや受容体に対する分子標的ペプチドの獲得に成功している。顆粒球コロニー刺激因子(G-CSF)受容体の場合、獲得された分子標的HLHペプチドは、強い結合活性(Kd = 3nM)をもち、G-CSFによる細胞増殖を完全に阻害した(IC50 = 75nM)。このペプチドは、強固なヘリックス構造を保持しており(helix 59%)、マウス血清を用いて酵素分解に対する安定性を経時的に追跡したところ、15日の半減期をもつことが判明した。さらに、マウスに免疫し、分子標的HLHペプチドが抗原性をもたないことを確認している(非免疫原性)。すなわち、分子標的HLHペプチドは、低分子量であるにもかかわらず抗体と同等の強力な結合活性(Kd:数nM以下)を示し、かつ酵素分解に対して高い安定性(血清中半減期:14日以上)をもち、非免疫原性であることから、従来の抗体医薬の問題点を一挙に解決し、これに代わりうる革新的医薬品開発につながる。
[4] 支援担当者の研究概要
“分子標的HLHペプチドを基盤とした新しい創薬モダリティーの開発”
21世紀に入るとともにヒトの遺伝子構造の全容が明らかにされた。現在,ゲノムから翻訳されるタンパク質の網羅的な解析が進められており,生命科学研究や医薬品開発の標的タンパク質が劇的に増えてきている。この急速なプロテオーム解析に迅速に対応するために,タンパク質?タンパク質相互作用を制御する分子標的化合物の新しい設計法が求められている。現在,タンパク質相互作用に対する分子標的ツールとして抗体が注目されており,また分子標的医薬品としても汎用されるようになってきている。しかし,抗体(抗体医薬)には,致命的な欠点があり,以下のような問題点が指摘されている(図3)。①抗体は,多数のジスルフィド結合を含む巨大タンパク質であるため,細胞内に導入したり,細胞内で機能させたりすることができず,細胞内の疾患関連タンパク質をターゲットとすることができない。②ヒトに対する抗原性を下げるため,ヒト化等が必要である。③モノクローナル抗体であるために生産に膨大なコストを必要とする。その結果として薬剤治療費が高騰し社会問題になっている。さらに,④抗体医薬の開発や生産には,特許の制限が複雑に絡み合っている。これらの問題点は全て,抗体の基本構造に起因するものである。そこで,本研究課題では,イムノグロブリン構造を利用せず,目的の標的タンパク質に対して特異的に結合する抗体様分子「分子標的HLHペプチド」の設計法を確立し,従来の抗体が抱える複数の課題をすべて克服する。
国内外において,非イムノグロブリン骨格の抗体様物質の研究が行われている。これらの全ては抗体様タンパク質で,天然タンパク質を土台にしているため,小さいものでも分子量が10,000を超え,その結果,免疫原性があり,また細胞膜透過性ないなどの問題を残している。一方,分子標的HLHペプチドは,完全de nove(天然タンパク質にはないアミノ酸配列)で設計されており,そのため分子量を5000以下に抑えることに成功している。その結果,非免疫原性,細胞透過性を獲得し,また低コストでの化学合成が可能になるなど,多くの点で優れており,非常に独自性の高いものである。