B7-1 クライオ電子顕微鏡法による生体分子構造解析の高分解能化と効率化
生体分子複合体の水溶液試料を電顕グリッド上で急速凍結後撮影し、収集した分子像の解析により立体構造を解析する技術を提供
[1] 支援担当者
| 所属 | ①大阪大学 大学院生命機能研究科 | |
|---|---|---|
| 氏名 | ①難波 啓一、加藤 貴之、宮田 知子 | |
| AMED 事業 |
ユニット/領域名 課題名 |
構造解析ユニット(構造解析領域) クライオ電子顕微鏡法による生体分子構造解析の高分解能化と効率化 |
| 代表機関 代表者 |
大阪大学 難波 啓一 |
|
| 支援技術のキーワード | クライオ電子顕微鏡、単粒子像解析法、膜タンパク質、繊維状複合体、高分解能化 | |
[2] 支援技術の概要
クライオ電子顕微鏡の単粒子像解析法による生体分子の立体構造解析は、X線のように結晶化を必要とせず、NMRのように対象分子の分子量に上限もなく、最近の技術進歩によりわずか数十マイクログラムの試料で原子分解能に近い構造解析が可能になり、しかも準安定な構造が混在するような試料であっても解析が可能である。そのため、これまで構造解析の対象となり得なかった試料でも解析可能になっている。それには膜タンパク質や繊維状複合体、そして柔軟な構造や内在的にフォールドしていない部分を持つタンパク質などを含む膨大な数の生体分子が含まれ、構造ゲノム科学や構造生命科学といった研究分野を大きく推進する基盤技術となりつつある。
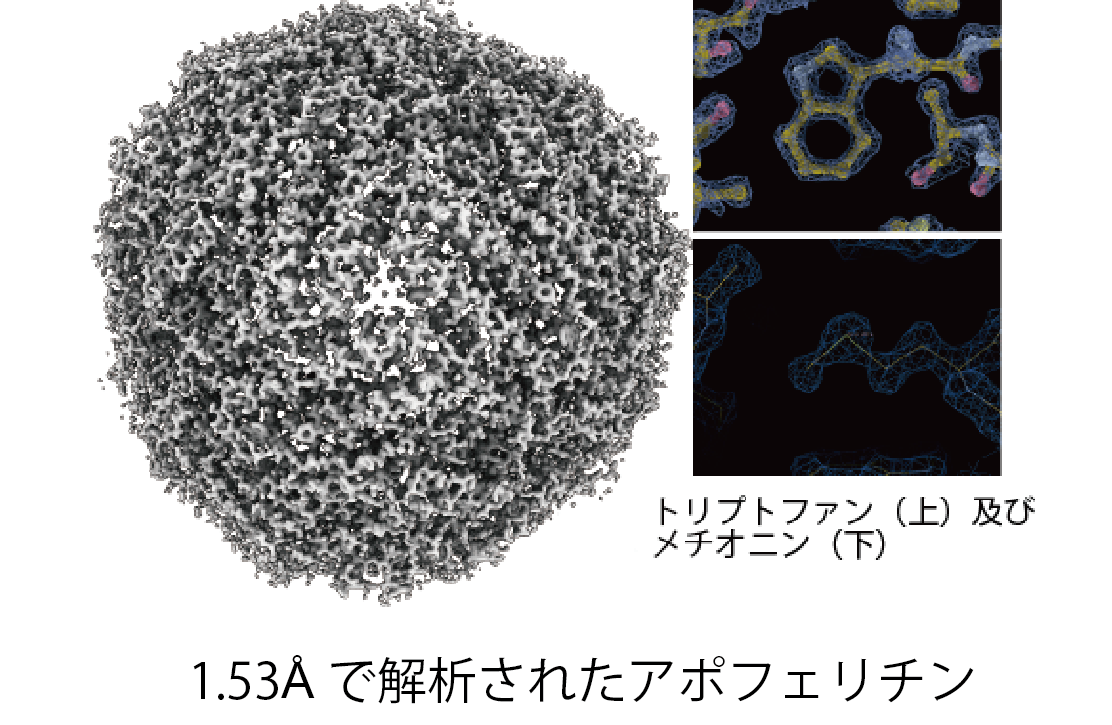
単粒子像解析法による構造解析の到達分解能は、電子線直接検知型CMOSカメラの導入により大幅に向上し、4Aを超える近原子分解能と分子モデルの構築はもはや特筆すべき成果ではなくなった。クライオ電子顕微鏡への電子分光装置の導入等による高画質電顕像の収集効率化と、さまざまな画像解析法の工夫により、数年前までは複数年を要していた構造解析期間が数日にまで短縮されている。2016年には最高到達分解能が初めて2.0 Aを超え、酵素GDHで1.8 Aの構造が報告されたが、2018年6月にはアポフェリチンで1.62 A分解能の構造が報告され、そして2019年2月には我々の研究グループが同じアポフェリチンで1.53 Aという世界最高分解能を達成した。これは、日本電子と共同開発した新型の自動クライオ電子顕微鏡CRYO ARM 300を活用した成果で、24時間で自動撮影したわずか840枚のクライオ電子顕微鏡像から得られた成果である。このように数少ない画像データで極めて高分解能を達成できた理由は、このクライオ電子顕微鏡に搭載した冷陰極電界放射型電子銃が発生する電子ビームの干渉性の高さにより、画像信号強度の高分解能での減衰が小さくなったことによる。
我々は構造生命科学分野の発展に貢献すべくこれらの最先端技術を提供し、試料のスクリーニング、クライオ電顕画像データの収集、画像解析と構造解析、そしてこの技術の教育トレーニングを含めて、様々な構造生命科学研究を支援する。
[3] 支援技術の利用例
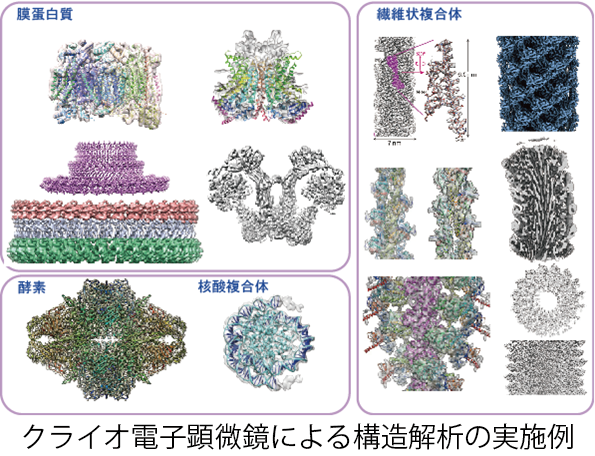
クライオ電子顕微鏡を用いた単粒子像解析法は、タンパク質や核酸など生体試料の水溶液を薄膜として急速凍結し、薄い氷に閉じ込めた生体分子の電子顕微鏡像を撮影し、画像解析により立体構造を求める手法であるため、安定に多数の粒子像が撮影できれさえすれば構造解析が可能である。例えば、試料溶液のpHや塩濃度を変えたり様々な基質を加えることで、通常とは異なったコンフォメーションの構造を解析することも可能である。
水溶液中での構造解析が可能なため、試料が水溶液中に溶けて分散しているかぎり、試料の形状もサイズも選ばない。そのため、ウィルスのような対称性の高く大きな複合体から、リボソームのような対称性のない複合体、繊維状に重合したタンパク質など、様々な形態の複合体試料で構造解析が可能である。可溶性タンパク質だけでなく、膜タンパク質のように可溶性でない分子であっても、界面活性剤によって可溶化するか脂質ナノディスクに組み込むことで水溶液中に分散させれば構造解析は可能となる。
生体試料は本質的に水溶液中で柔軟かつ動的に構造を変化させながらその機能を発揮する。分子のコンフォメーションを固定化しがちな結晶での構造解析では、その動態や機能発現にともなう構造変化を可視化することは困難である。しかし単粒子像解析法では、画像解析によって複数の異なったコンフォメーションを持つ粒子群を分類することが可能なため、分子の構造動態を解析することができる。
図はこれまでに解析された様々な生体試料の構造例である。
単粒子像解析法のこのように汎用性に優れた特性により、クライオ電子顕微鏡法は標的分子の構造を基盤とする医薬品開発にとって最も優れた手法となった。
[4] 支援担当者の研究概要
現在に至るまでの約30年間、細菌の運動器官であるべん毛の高速回転モーターやらせん型プロペラ、細菌が宿主感染時に使う3型病原性因子分泌装置とその原型であるべん毛タンパク質輸送装置、骨格筋のアクトミオシン繊維等、主に分子モーターを対象とし、それらが超分子ナノマシンとして働く仕組みを支える立体構造とその変化、そしてその形成機構や機能の解析を進めてきた。X線回折法とクライオ電子顕微鏡を組み合せて解明した詳細な立体構造から、生体分子の自己集合とその制御や、柔軟な立体構造中に実現される超高精度スイッチの仕組みを解明するとともに、光学ナノ計測法の時間分解能をマイクロ秒レベルに、空間分解能をナノメートルにまで高めて動的な振る舞いを詳細に観察してきた。その結果、人工機械に比べて桁違いに高い効率でエネルギーを変換する分子モーターの仕組みが、モーターを構成するタンパク質の結合解離の際に、構造的に非対称なタンパク質間相互作用が、ランダムな熱ゆらぎを一方向に偏らせることで実現されているらしいとの手掛かりを得た(Fujii & Namba 2017 Nature Commun.)。
クライオ電子顕微鏡による生体分子の立体構造解析法についても、1991年頃から長年にわたって独自の技術開発を進め、2004年には世界に先駆けて、クライオ電子顕微鏡像の画像解析によりタンパク質の主鎖や側鎖を初めて可視化することに成功した(Yonekura et al. 2004 Nature)。電子顕微鏡像の撮影にCCDやCMOSカメラを活用し始めた2000年代後半以降は、骨格筋アクチン繊維や細菌の病原性因子分泌装置のニードルなど、直径10 nm以下と極めて細いため詳細な立体構造観察は不可能であろうと思われていたものについても、1週間から1ヶ月という短期間のデータ収集と解析によって原子レベルの分解能を達成し、形態形成や動作の仕組みを明らかにした(Fujii et al. 2010 Nature; Yamada et al. 2019 投稿論文2報準備中)。以前は数年にもおよんだ大変な作業を大幅に効率化したことで、生命科学におけるこの解析技術の有効性と重要性を一層高めた。
2010年頃より日本電子社とともに、高度に自動化された高分解能クライオ電子顕微鏡CRYO ARMの開発を進めており、2016年に大阪大学に導入設置されたプロトタイプでは、3日間の自動撮影で得た約2500枚のクライオ電顕画像の解析により、β-galactosidaseの構造が2.4Å分解能で解けている(Kato et al. 2017 EMDB ID: EMD-6840)。2019年2月には理研Spring-8に設置された商用1号機のCRYO ARM 300を使い、アポフェリチンの構造を1.53Åという世界最高分解能で解明した(Kato et al. 2019 EMDB-9865)。これは24時間で自動撮影したわずか840枚のクライオ電子顕微鏡像から得られた成果で、このように数少ない画像データで極めて高分解能を達成できた理由は、CRYO ARM 300に搭載した冷陰極電界放射型電子銃が発生する電子ビームの干渉性の高さにより、画像信号強度の高分解能での減衰が小さくなったことによるものである。このように構造生物学と生物物理学の分野で常に世界最先端を牽引しており、今後も一層の貢献を目指している。